近日,华南理工大学生物医学科学与工程学院王均教授团队在肿瘤免疫治疗领域取得重要研究进展,通过研发纳米多特异性抗体,并持续推动其临床转化应用,为肿瘤免疫治疗领域的发展提供了新的技术路径与创新理念。相关成果以“Engineering multi-specific nano-antibodies for cancer immunotherapy”为题,于6月26日发表于Nature Biomedical Engineering上。
在肿瘤免疫治疗中,针对免疫检查点的单克隆抗体(单抗)药物占据重要地位,但由于其仅能识别单一靶点,临床应答率及治疗效果仍受限。如何提升疗效,让更多肿瘤患者受益,是医学界亟需解决的重要课题。与单抗药物相比,多特异性抗体能够识别两个或多个靶点,并同时靶向肿瘤细胞和免疫细胞,精准调控多个信号通路,实现对肿瘤的更有效打击,代表着抗体药物研发的新趋势和重要方向。
生产多特异性抗体的传统生产方法包括DNA重组、蛋白质工程技术等,这些方法存在诸多弊端,例如易产生大量副产物并导致产率低、纯化难度高,且抗体分子在制备过程中易出现降解、聚集、变性等问题,严重制约了相关药物的研发与应用。
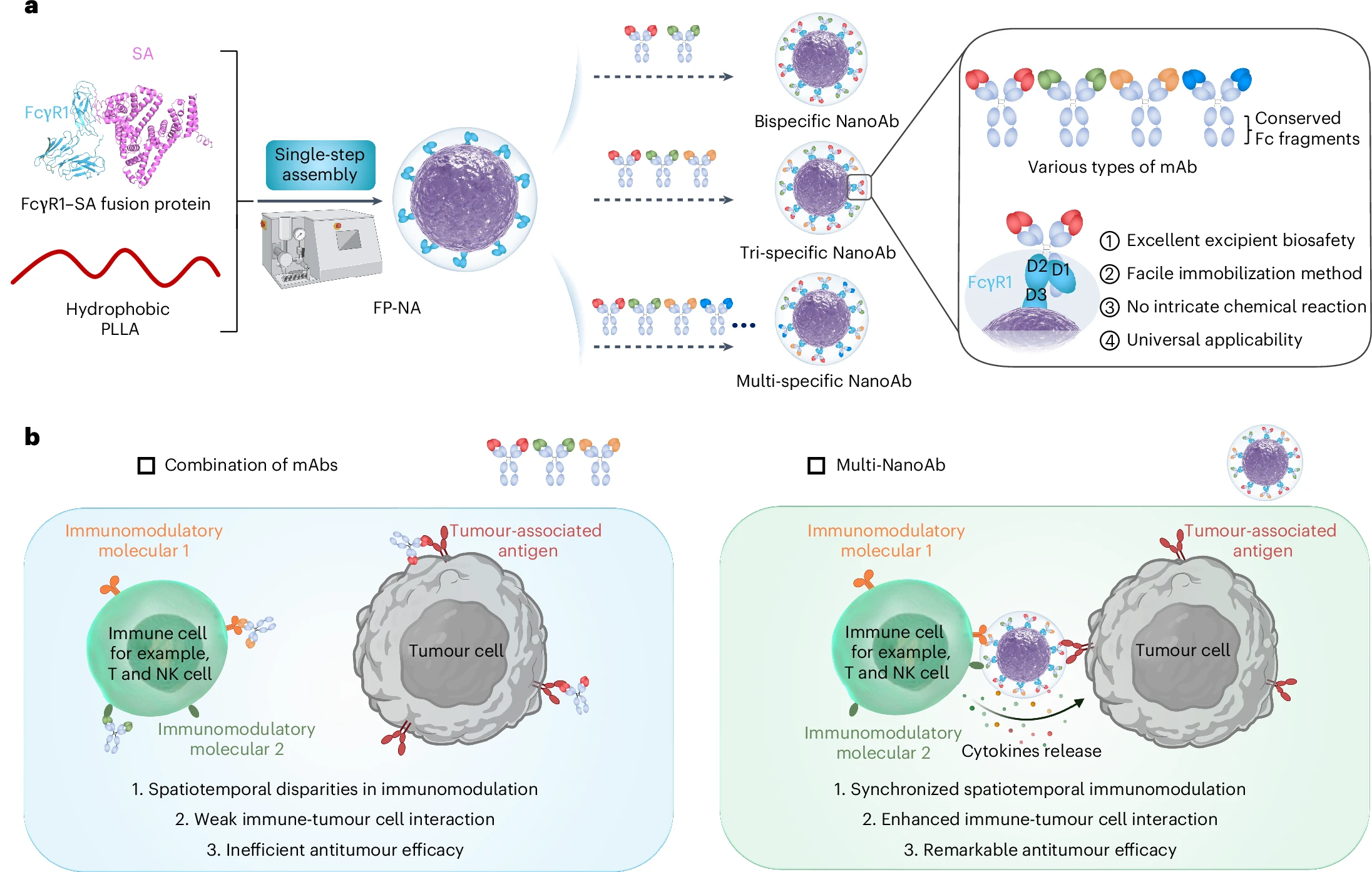
为解决这些问题,华南理工大学研究团队提出并发展了“纳米适配子”技术,能够高效构筑出纳米多特异性抗体。团队将两种或多种单克隆抗体固定于纳米粒子表面,模拟多特异性抗体功能,并进一步推动该技术向临床应用转化,致力于解决其制备工艺繁琐、抗体键合过程导致亲和力受损、载体生物安全性不足等难题。
在前期研究中,团队将能识别单克隆抗体保守Fc片段的抗Fc抗体键合于纳米载体表面,创新性地构建了通用型抗体固定平台“纳米适配子”,与两种或多种单克隆抗体药物混合后,可便捷、高效、可控地制备出纳米多特异性抗体。
基于融合蛋白复合型“纳米适配子”构筑的纳米多特异性抗体及其抗肿瘤机制
在本项研究中,为加速临床转化和应用,团队对“纳米适配子”技术进行了更新迭代,采用基因工程技术构建了由Fc受体与血清白蛋白组成的重组融合蛋白,并将其与生物医用高分子材料聚乳酸进行“一步法”可控组装,成功搭建了融合蛋白-聚合物复合型“纳米适配子”(FP-NA)。FP-NA可利用其表面的Fc受体,借助“受体-配体”相互作用,与单抗药物的Fc段结合,可以在避免复杂化学偶联过程的同时,装配式构建出纳米多特异性抗体,实现单抗药物的多价化、多特异性化以及多功能化。
这种纳米多特异性抗体能显著增强T细胞、巨噬细胞等免疫细胞对肿瘤细胞的识别、杀伤能力。在包括人源化小鼠肿瘤模型等多种肿瘤模型中,充分验证了基于“纳米适配子”构建的纳米多特异性抗体具有极其显著的抗肿瘤效应,具有良好的应用前景。
目前,团队已完成“纳米适配子”的放大试制及关键技术验证,有望突破传统生产技术的局限,推动新型抗体药物的研发,为肿瘤等疾病的治疗开辟新途径。
华南理工大学为该项成果的唯一署名单位,论文第一作者为生物医学科学与工程学院博士后范亚楠,通讯作者为王均教授、沈松准聘副教授。学校生物医学学科充分发挥博士后队伍在学科发展、原始创新成果中的“蓄水池”和“生力军”作用,多维度强化博士后队伍建设,形成了一套特色鲜明的培养体系。
生物医学科学与工程学院不断完善与健全博士后管理制度,在有力推动博士后招收的同时严把招收关,鼓励导师积极参与指导博士后的培养,在学术、科研、工作生活中为博士后提供密切指导和帮助。学院坚持“破五唯”,尊重人才的科研兴趣,配置一流“软”“硬”环境,提供国内外学科前沿的学术交流与合作平台,为博士后搭建起科研攻关的“助推器”。
在该学科培育的博士后中,11人在站期间获批国家自然科学基金青年科学基金项目,16人获批中国博士后科学基金资助,多次在国际顶级期刊上发表高水平创新成果,为学科高质量发展注入创新效能,不断为人类医学健康发展做出新的科学发现。
·相关成果链接:
https://www.nature.com/articles/s41551-025-01425-5
文字:生物医学科学与工程学院
图片:生物医学科学与工程学院
视频:
编辑:杨晓霓
责任编辑:徐培木




